Поддержите создание крупнейшего раздела на «Онко Вики» — об опухолях головы и шеи
ПоддержатьPh+ и Ph-like ОЛЛ
Ph+ и Ph-like являются подвидами В-клеточного острого лимфобластного лейкоза (В-ОЛЛ). Особенность этих подвидов заключается в специфических генетических изменениях в опухолевых клетках.
Что такое Ph+ ОЛЛ?
Этот подвид ОЛЛ характеризуется определенной хромосомной перестройкой в опухолевых клетках. Хромосомы – это структуры внутри клеток, которые содержат гены человека. При Ph+ лейкозе происходит отрыв определенного участка 9 хромосомы и присоединение его к 22 хромосоме. Такое перемещение называется транслокацией. Одновременно с этим отрывается участок из 22 хромосомы и присоединяется уже к 9 хромосоме (см. рис.). Измененная 22 хромосома называется “Филадельфийской”, именно поэтому такой подтип лейкоза имеет необычное название – Ph-позитивный (Ph+ ОЛЛ, т.е. ОЛЛ с наличием филадельфийской хромосомы).
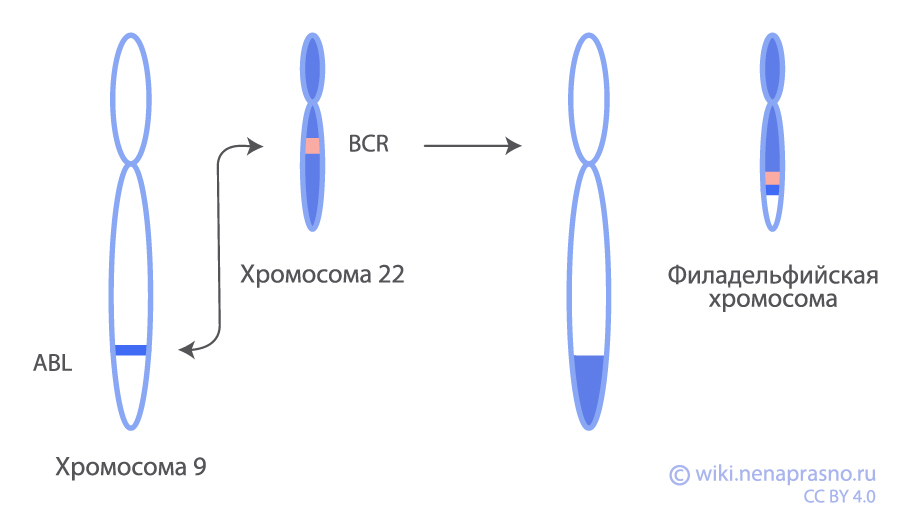
Такая хромосомная перестройка приводит к тому, что создается новый ген, который называется BCR-ABL1. В результате работы этого гена образуется белок с таким же названием BCR-ABL1. Он обладает свойствами тирозинкиназы (фермента, передающего сигнал внутрь клетки, запускающего и усиливающего деление и рост), что приводит к образованию и бесконтрольному делению лейкемических (т.е. опухолевых) клеток.
Ph+ОЛЛ встречается примерно у 3-4% детей с ОЛЛ. Частота встречаемости Ph+ОЛЛ увеличивается с возрастом, т. е. у детей более старшего возраста риск заболеть этим лейкозом выше.
Что такое Ph-like ОЛЛ?
Это уже другой подтип острого лимфобластного лейкоза, который также называют Ph-подобным ОЛЛ (Ph означает Филадельфийскую хромосому).
При этом подтипе генетические особенности опухолевых клеток схожи с Ph+ОЛЛ, но ген BCR-ABL1 не образуется. Вместо этого у пациентов встречаются разнообразные варианты других генетических мутаций. Как при Ph+ОЛЛ, так и при Ph-like ОЛЛ внутри опухолевых клеток запускается целый ряд процессов, которые приводят к чрезмерной активации деления и роста. Но при Ph+ОЛЛ событием, запускающим этот сложный процесс, является образование гена BCR-ABL1, а при Ph-like ОЛЛ — другие мутации. Подробнее о том, какие именно мутации могут встречаться при Ph-like ОЛЛ, написано в разделе про лечение (см. ниже).
Таким образом, разные механизмы активируют одну и ту же передачу сигналов внутрь клетки. Именно это и объединяет два вида лейкоза, а также позволяет применять схожую стратегию лечения.
Ph-подобный ОЛЛ встречается у 10-20% детей с В-ОЛЛ. Частота встречаемости повышается с возрастом. Также чаще им болеют мальчики и пациенты с синдромом Дауна.
В чем отличие Ph+ и Ph-like ОЛЛ от других острых лейкозов?
Ph+ и Ph-like ОЛЛ имеют много общего с другими подтипами ОЛЛ.
Во-первых, для них характерны такие же симптомы и проявления болезни, как и для всех ОЛЛ. Во-вторых, для постановки этих подтипов лейкозов используются точно такие же методы диагностики.
Основное отличие заключается в специфических молекулярно-генетических особенностях: транслокации с образованием Филадельфийской хромосомы и гена BCR-ABL1 для Ph+ОЛЛ, и определенных генетических изменениях для Ph-like ОЛЛ.
Наличие этих изменений определяется цитогенетическим и молекулярно-генетическими методами. Каждому ребенку, у которого впервые диагностирован В-ОЛЛ, обязательно проводят анализ на наличие Филадельфийской хромосомы и других генетических аномалий. Поэтому диагноз Ph+ и Ph-like В-ОЛЛ устанавливается уже при первичном обследовании.
Данные подтипы лейкоза относятся к группе высокого риска и требуют особого подхода к лечению.
Особенность лечения Ph+ и Ph-like ОЛЛ
Как и при других типах ОЛЛ, лечение состоит из трех этапов (индукция, консолидация, поддерживающая терапия). Также проводится профилактика или лечение поражения ЦНС (нейролейкемии).
Особенности лечения Ph+ОЛЛ
Ключевая особенность лечения состоит в том, что помимо химиотерапии обязательно используется таргетная терапия.
Стандартно пациенты с таким подтипом лейкоза получают комбинированную химиотерапию с ингибиторами тирозинкиназы (ИТК) – они назначаются на протяжении всех 3-х фаз лечения. ИТК подавляют активность образовавшегося белка BCR-ABL1, тем самым предотвращая рост и размножение лейкемических клеток.
Ингибиторы тирозинкиназы являются ключевым звеном в лечении пациентов с Ph+ и Ph-like ОЛЛ. До появления этих лекарственных препаратов прогноз у детей с такими диагнозами был крайне неблагоприятный и требовал проведения аллогенной трансплантации костного мозга. Добавление ИТК в схему лечения позволило избежать обязательного назначения ТГСК всем пациентам.
Чаще всего назначаются такие препараты как иматиниб и дазатиниб (но могут применяться и другие – в зависимости от течения заболевания, особенностей опухолевых клеток и осложнений лечения). Лекарства принимаются в виде таблеток через рот.
Общие побочные эфекты таргетной терапии могут включать снижение количества клеток крови, возможные кровотечения, тошноту и рвоту, понос, слабость, появление сыпи, а также головную боль или боль в мышцах и/или суставах. В редких случаях такие препараты могут вызвать задержку жидкости в организме. И очень редко могут встречаться нарушения ритма сердца, образования тромбов.
Важно отметить, что обычно побочные эффекты таргетной терапии менее опасны, чем осложнения химиотерапии, и такая терапия переносится детьми намного лучше.
После окончания этапа индукции ремиссии происходит распределение пациентов на две группы риска в зависимости от ответа на терапию (наличие или отсутствие ремиссии/статус минимальной остаточной болезни):
- стандартная группа риска – у ребенка зафиксирована клинико-гематологическая ремиссия, а также отсутствует минимальная остаточная болезнь (или определяется лишь небольшой уровень);
- высокая группа риска – у ребенка нет полной ремиссии и/или высокий уровень МОБ.
Для пациентов стандартного риска на этапе консолидации продолжается химиотерапия вместе с ингибиторами тирозинкиназы. А для пациентов высокой группы риска в период консолидации может быть назначено продолжение химиотерапии вместе с ингибиторами тирозинкиназ, назначение иммунотерапии или CAR-T терапии. Согласно международным рекомендациям, таким пациентам рекомендуется участие в клинических исследованиях.
Для пациентов стандартной группы риска в период поддерживающей терапии продолжается химиотерапия вместе с ингибиторами тирозинкиназы. Известно, что трансплантация гемопоэтических стволовых клеток (ТГСК) не улучшает результаты терапии у этой группы риска.
Для пациентов высокой группы риска рекомендовано проведение ТГСК с последующей поддерживающей терапией ингибиторами тирозинкиназы.
Особенность лечения Ph-like ОЛЛ
Пациенты с таким типом лейкоза относятся к высокой группе риска. Как и для других подтипов, химиотерапия в этом случае остается основным элементом в схеме лечения и состоит из тех же 3-х фаз. На текущий момент отсутствует стандарт терапии такого подтипа заболевания.
Данные недавних исследований показали, что назначение ингибиторов тирозинкиназ и другой таргетной терапии может способствовать улучшению прогноза. Так как этот тип лейкоза характеризуется большим разнообразием мутаций (в отличие от Ph+ОЛЛ), назначение таргетной терапии будет зависеть от конкретных генетических изменений в опухолевых клетках в каждом конкретном случае.
Ученые и врачи условно выделяют как минимум три группы в зависимости от мутационных изменений при Ph-Like ОЛЛ:
- Первая группа включает пациентов с мутациями в генах, ответственных за работу тирозинкиназ: ABL1, CSF1R и PDGFRB. Часто в этой группе пациентов назначение ингибиторов тирозинкиназ (дазатиниб или другие) позволяет воздействовать на опухолевые клетки и приносит пользу пациентам.
- Вторая группа включает пациентов с мутациями в сигнальном пути CRLF2/JAK и часто сопровождается мутациями в гене IKZF1. Обычно таким пациентам не помогают стандартные ингибиторы тирозинкиназ, но могут помочь JAK-ингибиторы (например, руксолитиниб).
- Третья группа пациентов имеют мутацию в других генах, которые повторяют профиль экспрессии (т.е. активации) тех же генов, что и при образовании гена BCR-ABL1, но не имеют мутаций, которые относятся к 1-ой или 2-ой группе. Таким пациентам может помочь назначение ингибиторов тирозинкиназ.
Таким образом, у ряда пациентов с определенными мутациями в период консолидации к химиотерапии может быть добавлена таргетная терапия: ингибиторы тирозинкиназы (дазатиниб и другие), а также руксолитиниб, который тоже подавляет передачу сигнала внутрь опухолевых клеток и не дает им делиться.
Так как (в отличие от Ph+ОЛЛ) для данного подтипа характерно большее количество различных мутаций, это затрудняет первый выбор и дальнейший подбор таргетной терапии. Всем пациентам этого подтипа лейкоза рекомендовано по возможности проводить лечение в рамках клинических исследований: это позволяет пациенту получить предположительно более эффективную терапию, а ученым сделать выводы для дальнейшего улучшения результатов.
Как и при предыдущем подтипе, лечение зависит от статуса на момент окончания индукции, уровня МОБ. Могут назначаться такие препараты, как блинатумумаб, CAR-T.
В данной группе пациентов – в связи с неблагоприятным прогнозом и высокой частотой рецидива – после окончания лечения рекомендовано рассмотреть проведение ТГСК.
Прогноз
Важно! Информация о прогнозе может быть чувствительной. Следует знать, что она основана на статистических данных о продолжительности жизни после лечения пациентов с определенным видом рака и не может расцениваться как индивидуальный прогноз. Предсказать, как будет развиваться болезнь, какой будет реакция на лечение, произойдет ли рецидив, и если да, то как скоро — невозможно. Бывает так, что даже при неблагоприятном прогнозе ситуация меняется к лучшему, вопреки статистике. Подробнее об этом читайте в статье «Плохие прогнозы не всегда сбываются»: колонка онколога о статистике и надежде».
Как было сказано ранее, исторически наличие гена BCR-ABL1 было ассоциировано с крайне неблагоприятным прогнозом (особенно с высоким уровнем лейкоцитов и медленным ответом на терапию). Наличие этого гена являлось показанием для проведения ТГСК в первой ремиссии.
Добавление к стандартной терапии ингибиторов тирозинкиназы значительно улучшило прогноз у таких пациентов, а также позволило избежать обязательного назначения ТГСК всем пациентам. Таким образом, примерные показатели 5-летней бессобытийной выживаемости (БСВ) – примерно 70%, что намного выше, чем до внедрения ингибиторов тирозинкиназ (когда 3-летняя БСВ составляла 35%).
На данный момент пациенты с Ph-like ОЛЛ имеют неблагоприятный прогноз даже несмотря на проводимую терапию. По данным некоторых исследований 5-летняя БСВ у детей варьирует от 40% до 58%. Добавление таргетной терапии у таких пациентов может приводить к увеличению показателей выживаемости.
Выводы
- Ph+ и Ph-like (Ph-подобный) ОЛЛ являются отдельными видами В-клеточного острого лимфобластного лейкоза.
- Для Ph+ ОЛЛ характерна специфическая транслокация с образованием Филадельфийской хромосомы и белка BCR-ABL1.
- Ph-like ОЛЛ имеет генетический профиль мутаций сходный с Ph+ОЛЛ, но при нем отсутствует Филадельфийская хромосома и не происходит выработка белка BCR-ABL1.
- Главная особенность лечения данных подтипов ОЛЛ заключается в добавлении таргетной терапии к стандартной химиотерапии.
- Применение ингибиторов тирозинкиназ у пациентов с Ph+ ОЛЛ позволило значительно улучшить прогноз и избежать обязательного назначения ТГСК всем пациентам.
- Терапия пациентов с Ph-like ОЛЛ может включать в себя таргетную терапию и зависит от конкретных мутаций, выявленных в опухолевых клетках.
Что еще почитать?
- Рекомендации NCCN по лечению ОЛЛ у детей для родителей пациентов (на английском языке).
- Информационный буклет, посвященный ОЛЛ у детей (на английском языке).
- Статья, посвященная ОЛЛ у детей от клиники Святого Иуды (на русском языке).
Обратитесь к врачу
Наши статьи написаны с учетом принципов доказательной медицины. При подготовке материалов мы обращаемся за консультациями к практикующим врачам и ссылаемся на авторитетные источники. Однако все наши тексты носят рекомендательный характер и не заменяют визит к специалисту.

Материалы подготовлены при поддержке программы “Эффективная филантропия” Благотворительного фонда Владимира Потанина.