Поддержите создание крупнейшего раздела на «Онко Вики» — об опухолях головы и шеи
ПоддержатьТрансплантация гемопоэтических стволовых клеток при ОЛЛ
Если у пациента с острым лимфобластным лейкозом установлены факторы риска при первичной постановке диагноза, произошел рецидив заболевания или химиотерапия не справляется с лечением, встает вопрос о возможности проведения трансплантации гемопоэтических стволовых клеток (ТГСК).
Как проводится ТГСК при ОЛЛ?
Перед ТГСК систему кроветворения пациента подавляют с помощью подготовительной химиотерапии (кондиционирования) приблизительно в течение недели, иногда с облучением всего тела, чтобы избавиться от оставшихся злокачественных клеток и освободить место для новых (донорских). После этого систему кроветворения пациента “перезапускают” с помощью трансплантации стволовых клеток. Гемопоэтические стволовые клетки здорового донора переливаются в кровоток пациента, где они приживаются и начинают производить здоровые эритроциты, лейкоциты и тромбоциты. Помимо этого, возникает так называемый эффект “трансплантат против опухоли”, при котором клетки донора помогают уничтожить остаточные опухолевые клетки.
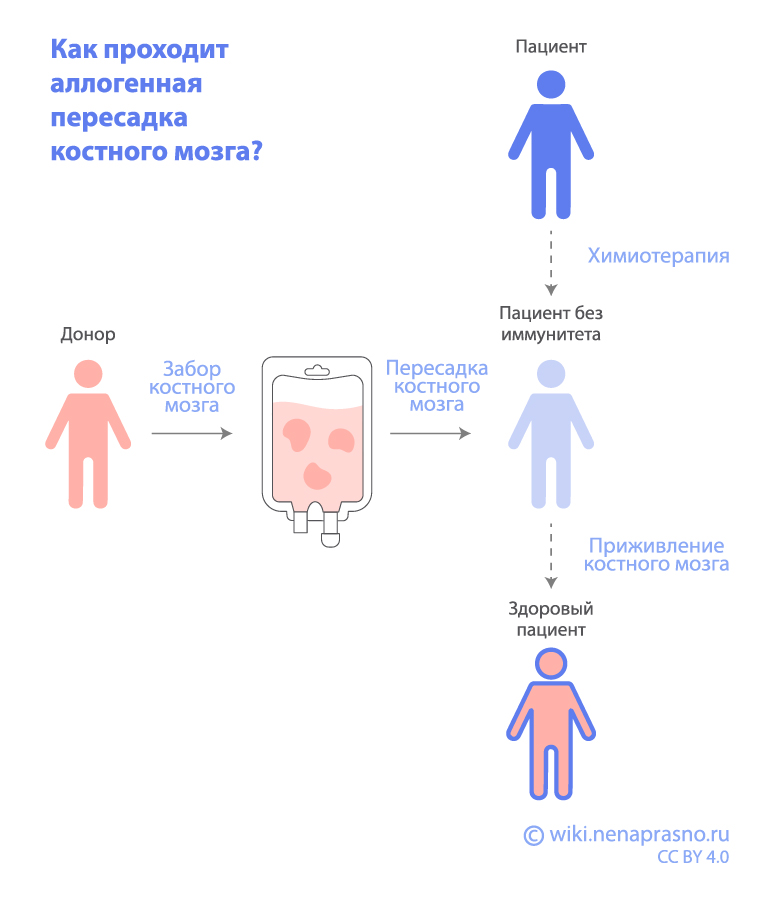
Сама процедура трансплантации выглядит как переливание продуктов крови через внутривенный катетер и занимает от 1 часа до нескольких в зависимости от объема трансплантата и веса пациента. В течение этого времени пациент находится в палате, а медсестры и врачи тщательно контролируют его состояние. В ходе переливания и после его завершения могут возникнуть некоторые побочные эффекты. Распространенные включают тошноту, рвоту, першение в горле или кашель. Возможны также повышение температуры, озноб и низкое кровяное давление.
ТГСК может быть аутологичной, когда донором является сам пациент, и аллогенной, при которой стволовые клетки получают от родственных и неродственных доноров. В лечении ОЛЛ применяется только аллогенная трансплантация (алло-ТГСК).
В качестве источников стволовых клеток могут использоваться: костный мозг, периферическая кровь и пуповинная (редко).
Когда показана ТГСК?
Выбор тактики лечения ОЛЛ зависит от группы риска. Пациент относится к той или иной группе риска в зависимости от разных параметров заболевания. Группа риска означает вероятность того, что болезнь не поддастся лечению (рефрактерные лейкозы) либо вернется после первоначальной положительной реакции на терапию. Чем выше группа риска, тем более интенсивное лечение получает пациент.
ТГСК – довольно сложный и трудоемкий процесс. Эта процедура часто тяжело переносится пациентом и сопряжена с большими рисками инфекционных, иммунных или токсических осложнений химио- и лучевой терапии. Поэтому ее проводят только в тех случаях, когда тяжесть состояния пациента оправдывает риски осложнений. Существуют два основных показания для проведения ТГСК при ОЛЛ у детей. Трансплантация необходима:
- Пациентам с высокими и очень высокими рисками рецидива, достигшим первой полной ремиссии. Чаще всего это больные с плохим ответом на химиотерапию.
- Пациентам с первым и последующим рецидивом ОЛЛ. Всем пациентам с рецидивом острого лимфобластного лейкоза из Т-лимфоцитов (Т-ОЛЛ) и с рецидивом во время химиотерапии или в течение 6 месяцев после нее (очень ранний и ранний рецидив) при В-ОЛЛ показана алло-ТГСК от любого типа донора. При позднем рецидиве В-ОЛЛ не всегда может потребоваться трансплантация.
Независимо от выбранного протокола лечения пациентов с генетическими аномалиями – транслокациями хромосом t(9;22) или Ph+ ОЛЛ и t(4;11) – относят к группе очень высокого риска и с самого начала рассматривают возможность выполнения алло-ТГСК. Однако из-за частых обновлений клинических протоколов, внедрения новых препаратов и совершенствования тактики лечения показания к трансплантации время от времени меняются, поэтому конкретный случай будет рассматриваться врачами индивидуально.
Необходимые условия для успешной ТГСК
Положительный результат ТГСК в большей степени зависит от следующих факторов:
- Состояние пациента. Он должен быть полностью обследован, не иметь инфекций и других осложнений на момент начала процедуры.
- Наличие подходящего донора.
- Своевременность выполнения. При ОЛЛ крайне важно успеть провести трансплантацию в тот момент, когда пациент находится в полной ремиссии.
Зачем нужны ремиссия до ТГСК и мониторинг МОБ?
Известно, что наличие минимальной остаточной болезни (МОБ) после химиотерапии связано с неблагоприятным прогнозом и высокой частотой рецидивов. Обнаружение МОБ на 36 сутки от начала лечения является мощным прогностическим фактором, свидетельствующим о необходимости применения в дальнейшем алло-ТГСК.
Необходимыми условиями успешной трансплантации являются достижение ремиссии после проведенной терапии и отсутствие МОБ. 5-летняя выживаемость после ТГСК в различных исследованиях различается, но в целом составляет 80-90% для пациентов, пришедших на трансплантацию без МОБ, и 50-60% для пациентов с МОБ.
Частота рецидива у пациентов с минимальной остаточной болезнью перед ТГСК значимо больше в сравнении с теми, у кого она отсутствует, и достигает 39–53%. Перед проведением ТГСК им дополнительно может быть назначена иммунотерапия или клеточная терапия, чтобы пациенты достигли полной ремиссии, а шансы на долгосрочную выживаемость повысились.
Кто может быть донором?
Результат трансплантации частично зависит от соответствия между донором и реципиентом по тому, какие антигены находятся на поверхности лейкоцитов (HLA – human leukocyte antigen). Для этого проводится HLA-типирование донора и реципиента. При генетической несовместимости повышается вероятность развития одного из самых опасных осложнений – реакции «трансплантат против хозяина» (РТПХ), а также риск неприживления и отторжения трансплантата.
Идеальным донором является близнец, т.е. брат или сестра с идентичным НLA, далее следуют брат или сестра с совместимым HLA. Если их нет или они имеют противопоказания к донорству, могут использоваться клетки родственных HLA-несовместимых доноров (например, родителей — гаплоидентичных доноров) или неродственных совместимых (из российского или международных донорских регистров).
Результат трансплантации в большей степени зависит от статуса болезни и состояния пациента перед трансплантацией, чем от источника стволовых клеток. Куда более важно успеть провести ТГСК во время ремиссии, а поиск неродственного донора может занять драгоценное время, т.к. далеко не у всех есть совместимые родственные доноры. Поэтому в РФ приоритет часто отдается гаплоидентичным донорам, т.е. родителям, которые всегда находятся рядом с ребенком и их можно быстро обследовать на возможность донорства. При этом от типа донора зависит режим кондиционирования и профилактики РТПХ.
Кондиционирование перед ТГСК
Кондиционирование — это подготовка пациента с помощью химио- и лучевой терапии к переливанию ГСК. Этот этап необходим для достижения двух целей:
- уничтожить в организме максимальное количество опухолевых клеток,
- подавить иммунитет пациента, чтобы предотвратить отторжение трансплантата, то есть пересаживаемых донорских клеток.
Выбор комбинации и интенсивности кондиционирования зависит от возраста и состояния пациента, источника трансплантируемых клеток, степени совместимости между донором и реципиентом, типа и стадии болезни.
Существует 2 вида режима кондиционирующей терапии перед трансплантацией:
-
Миелоаблативный — направленный на уничтожение, помимо раковых, всех клеток в костном мозге. Их заменяют донорскими стволовыми клетками. Этот вид лечения очень интенсивный, включает высокие дозы химиотерапии и при необходимости облучение. Перед алло-ТГСК при остром лимфобластном лейкозе у детей старше 3 лет обычно используется миелоаблативный режим с тотальным облучением всего тела. Он нужен для снижения частоты случаев отторжения трансплантата и рецидива.
-
Немиелоаблативный — режим с более низкими дозами химиотерапии, облучения или без него. Применение миелоаблативного кондиционирования может быть использовано у молодых пациентов без сопутствующих заболеваний, т.к. это агрессивная терапия, полностью подавляющая иммунитет пациента для лучшего приживления донорских стволовых клеток. При проведении повторных алло-ТГСК может использоваться немиелоаблативный режим для снижения риска осложнений. Также он может применяться у пациентов в возрасте или с незлокачественными заболеваниями.
Иммуносупрессия и другая терапия
Для предупреждения реакции «трансплантат против хозяина» (РТПХ) и отторжения трансплантата после ТГСК пациент получает курс иммуносупрессии продолжительностью до 6 месяцев. В отличие от кондиционирования, при иммуносупрессивной терапии иммунная система в значительной степени сохраняет свои функции, а подавляются только иммуноагрессивные клетки, способные вызвать РТПХ.
Часто пациентам на этом и последующих этапах требуется интенсивная сопроводительная терапия (антибиотики, противовирусные, противогрибковые препараты, парентеральное питание).
Рецидив ОЛЛ после ТГСК
Рецидив ОЛЛ после проведения трансплантации до сих пор остается неразрешенной терапевтической проблемой. В среднем заболевание возвращается у 10-40% перенесших алло-ТГСК. Пациентам с рецидивом в качестве продолжения лечения могут назначить клеточную или иммунотерапию.
Для достижения ремиссии, при удовлетворительном состоянии пациента, возможно проведение повторной алло-ТГСК, если время между первой трансплантацией и рецидивом превышает 6-12 месяцев. 5-летняя выживаемость пациентов с острым лимфобластным лейкозом после повторной трансплантации составляет около 30%.
Из-за неблагоприятных общих исходов у таких пациентов необходимы дальнейшие исследования и разработки новых лекарственных средств. Возможным вариантом лечения может быть включение в протоколы клинических исследований новых препаратов.
Выводы
- Кандидатами на алло-ТГСК могут быть только дети и подростки с высоким или очень высоким риском рецидива, определение которого зависит от точной стадии ОЛЛ, реакции на химиотерапию, времени начала рецидива и некоторых других параметров.
- Уровни МОБ во время химиотерапии, а также до и после трансплантации являются важными показателями исхода после ТГСК.
- Успешная трансплантация — это совокупность многих факторов. Она зависит от выбора оптимального донора, режима кондиционирования, профилактики РТПХ и общего состояния пациента перед процедурой.
- Проведение ТГСК полностью не исключает возможности возникновения рецидива. Возвращение болезни после этого этапа лечения дает неблагоприятные прогнозы.
Что еще почитать?
- Статья о ТГСК от портала госпиталя Св. Иуды (США) (на русском языке).
- Трансплантация костного мозга: что нужно знать пациенту (на русском языке).
Обратитесь к врачу
Наши статьи написаны с учетом принципов доказательной медицины. При подготовке материалов мы обращаемся за консультациями к практикующим врачам и ссылаемся на авторитетные источники. Однако все наши тексты носят рекомендательный характер и не заменяют визит к специалисту.

Материалы подготовлены при поддержке программы “Эффективная филантропия” Благотворительного фонда Владимира Потанина.
