Поддержите создание крупнейшего раздела на «Онко Вики» — об опухолях головы и шеи
ПоддержатьЛабораторные методы диагностики острых лейкозов
Морфологическое исследование
После взятия образца костного мозга материал попадает в лабораторию, где выполняются исследования для постановки диагноза.
Сначала проводится исследование образца костного мозга морфологическим методом (миелограмма). Это исследование мазка костного мозга под микроскопом, во время которого врач-морфолог проводит подсчет бластных клеток. Бластные клетки (бласты) – это клетки, которые остановились на пути превращения в полноценно зрелую клетку крови. При исследовании под микроскопом врач может наблюдать визуальное отличие бластных клеток от здоровых и может их посчитать. При обнаружении более 25% бластных клеток ставится диагноз “острый лейкоз”.

Существуют два основных типа бластных клеток, которые можно различить через микроскоп. Лимфобласты – клетки, размножающиеся при остром лимфобластном лейкозе (ОЛЛ), и миелобласты – при остром миелоидном лейкозе (ОМЛ). Лимфобласты являются предшественниками лимфоцитов, а миелобласты – гранулоцитов (нейтрофилов, эозинофилов, базофилов). Существуют также недифференцированные бласты — самые ранние предшественники клеток крови.
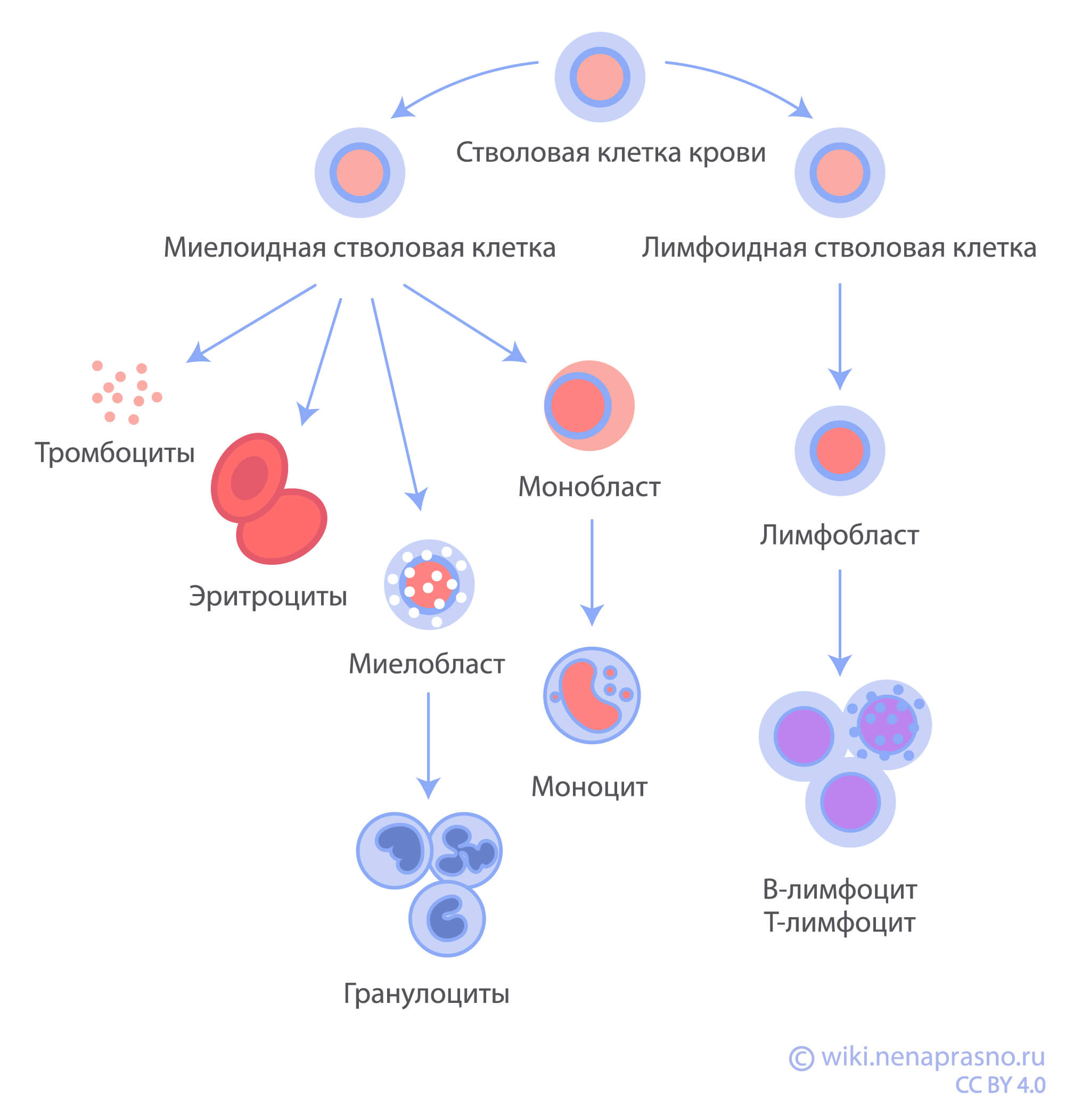
Для более точного определения типа острого лейкоза необходимы другие диагностические методы. Например, иммунофенотипирование, цитохимические и молекулярно-генетические исследования. По их результатам можно определить прогноз заболевания и подобрать лечение.
Цитохимические исследования
Цитохимические методы используются для установления подтипа ОЛЛ и ОМЛ. Они проводятся путем добавления определенных химических агентов к образцу костного мозга. После их взаимодействия с ферментами и другими веществами бластных клеток можно подтвердить, в какой тип клеток развиваются данные бласты , а также степень их зрелости. Это частично помогает понять, на каком этапе созревания клетки произошла «поломка», но для получения полной информации о заболевании требуются более точные методы исследований.
Иммунофенотипирование
Чем точнее и раньше определить тип острого лейкоза, тем с большей долей вероятности можно будет подобрать эффективное лечение. Более чувствительным, чем морфологическое и цитохимическое исследование, является иммунофенотипирование костного мозга.
В процессе развития клетки на ее мембране появляется разный спектр белков-маркеров. По тому, какие маркеры появились на клетке, можно понять степень ее зрелости. Такие маркеры по-другому называются антигены, а спектр этих маркеров на определенной клетке – иммунофенотип. Поэтому исследование для определения типа клеток и степени их развития на основе спектра этих маркеров называется иммунофенотипирование. Изучив иммунофенотип опухолевой клетки, можно не только точно определить, на какой стадии развития она остановилась и какой подтип лейкоза у пациента, но и выявить мишени для применения иммунотерапии и клеточной терапии.
Кроме того, данный метод позволяет обнаружить рецидив рака еще до того, как опухолевые клетки можно будет увидеть в микроскоп. Это очень важно с точки зрения контроля рецидива. Данный метод используется при оценке минимальной остаточной болезни (МОБ) в процессе терапии и позволяет выявить 1 опухолевую клетку среди 10 000 – 100 000 здоровых, если такая имеется. Таким образом, этот метод также позволяет с высокой точностью выявить количество бластных клеток и определить прогноз и тяжесть заболевания.
Молекулярно-генетические методы
Заключительным этапом диагностики острых лейкозов являются молекулярно-генетические методы, позволяющие оценить “поломки” в ДНК клетки. Подробнее о том, что такое молекулярно-генетические исследования, можно прочитать здесь.
Наиболее распространенными методами в клинической практике являются кариотипирование, полимеразная цепная реакция (ПЦР), а также флюоресцентная гибридизация (FISH). Эти методы позволяют ответить на вопрос, присутствует ли какая-либо конкретная аномалия в хромосомах опухолевых клеток.
Самыми частыми хромосомными аномалиями, характерными для лейкозов, являются транслокации. Транслокация – это аномалия, при которой целая хромосома или сегменты хромосом неправильно объединяются с другими хромосомами в процессе деления, или фрагмент одной хромосомы встраивается в другую хромосому. В заключении анализа можно встретить условные обозначения, которые означают, между какими хромосомами произошел обмен генетическим материалом.
Например, у детей с ОЛЛ наиболее часто встречаются t(9;22), t(4;11), t(1;19), t(8;14) и t(12;21). А также при ОМЛ с высокой частотой обнаруживаются t(8;21), t(15;17) и t(9;11).
Помимо этого, могут встречаться потери участка хромосомы (делеции, обозначаются «del») или встраивание лишнего участка ДНК в хромосому (инсерция, обозначается «ins»). Подробнее о конкретных генетических аномалиях при разных типах лейкоза написано здесь.
Генетические “поломки” могут влиять на прогноз заболевания, использоваться для мониторинга минимальной остаточной болезни и для назначения таргетной терапии.
Помимо этого, существует метод секвенирования нового поколения (NGS), который также относится к молекулярно-генетическим методам. Этот метод позволяет обнаружить множественные генетические аномалии с высокой чувствительностью. Отдельные генетически разные типы лейкозных клеток, существуя по отдельности или в сочетании, обусловливают индивидуальное течение заболевания. Поэтому для повышения эффективности диагностики и мониторинга течения ОЛ актуальным является выявление максимального количества известных генетических аномалий. Однако, основными недостатками NGS являются технологическая сложность, высокая стоимость оборудования, расходных материалов, а также длительность выполнения анализа.
Выводы
- Морфологический анализ является первоначальным методом исследования костного мозга и позволяет визуально оценить бластные клетки, а также посчитать их количество.
- С помощью цитохимии можно определить тип лейкоза по веществам внутри клетки.
- Иммунофенотипирование позволяет получить иммунологический «портрет» клетки и детальнее определить стадию развития бластной клетки, чтобы подобрать тактику лечения. Помимо этого, иммунофенотипирование используется для мониторинга течения болезни.
- Молекулярно-генетические исследования проводятся для поиска генетической «поломки», которая привела к развитию данного заболевания, и подтверждения диагноза. В случае обнаружения поломок они также могут использоваться для мониторинга минимальной остаточной болезни, для определения группы риска, и в некоторых случаях – для назначения таргетной терапии.
Что еще почитать?
- Справочник MSD о лейкозах (на русском языке).
- Статья о принципах метода проточной цитометрии (на русском языке).
- Видео о методах диагностики ОЛ (на русском языке).
Обратитесь к врачу
Наши статьи написаны с учетом принципов доказательной медицины. При подготовке материалов мы обращаемся за консультациями к практикующим врачам и ссылаемся на авторитетные источники. Однако все наши тексты носят рекомендательный характер и не заменяют визит к специалисту.

Материалы подготовлены при поддержке программы “Эффективная филантропия” Благотворительного фонда Владимира Потанина.
