Поддержите создание крупнейшего раздела на «Онко Вики» — об опухолях головы и шеи
ПоддержатьОсобенности лечения HER2-позитивного рака молочной железы
HER2 — это белок-рецептор на поверхности клеток организма (рецептор - своеобразная “антенна” для коммуникации клеток друг с другом). В здоровой ткани он поддерживает нормальные темпы роста и развития клеток. В случае с раковыми клетками иногда возникает гиперэкспрессия HER2, то есть увеличение количества этих рецепторов, и клетки получают сигналы к беспорядочному делению.
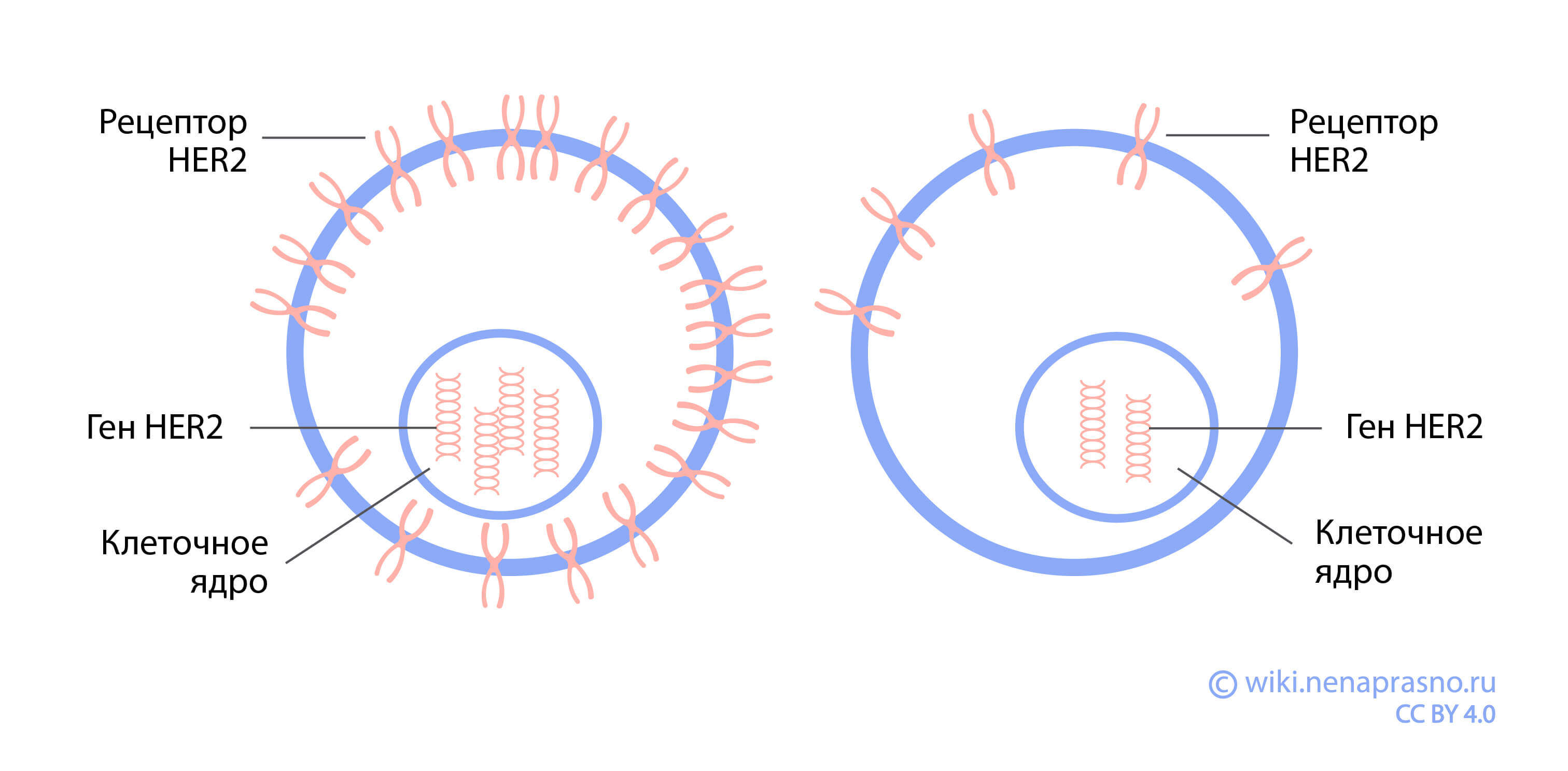
Определение уровня экспрессии данного белка важно для определения тактики лечения пациента. При обнаружении гиперэкспрессии HER2 появляется возможность для проведения таргетной терапии.
Подробнее о биологических подтипах рака молочной железы читайте здесь.
Таргетная терапия при HER2-позитивном раке молочной железы
Таргетная терапия (от англ. target — мишень) — это воздействие препаратами на конкретную цель на поверхности или внутри клетки. В случае с HER2-позитивным раком молочной железы, анти-HER2 препараты прицельно воздействуют на этот рецептор, который в неадекватно большом количестве присутствует именно в опухолевой ткани. Такой узкий спектр действия обусловливает невысокую токсичность по сравнению с обычными химиотерапевтическими препаратами. Таргетная терапия является частью комплексного лечения, тактика которого зависит от стадии и других особенностей опухоли.
К анти-HER2-препаратам относятся вещества, которые вводятся внутривенно (трастузумаб, пертузумаб, трастузумаб эмтанзин, трастузумаб дерукстекан), а также таблетированные формы, которые пациент принимает внутрь (лапатиниб).
Если помимо наличия повышенной экспрессии HER2 у пациентки выявлено гормонозависимое заболевание, это является показанием для дополнительного назначения гормональной терапии.
Как проводится лечение локализованного и местнораспространенного заболевания?
Подробнее о стадиях рака груди читайте здесь.
В случае, если опухолевые клетки находятся в пределах молочной железы или окружающих ее лимфатических узлов и не распространились на другие органы и ткани, лечение нацелено на полное удаление опухоли из организма. Могут быть показаны следующие варианты лечения:
- при размере опухоли менее 2 см и при отсутствии метастазов в лимфатические узлы: хирургическое вмешательство + адъювантная (послеоперационная) химио-таргетная терапия;
- при размере опухоли более 2 см и/или наличии метастазов в лимфоузлах: неоадъювантная (предоперационная) химио-таргетная терапия + хирургическое вмешательство + адъювантная (послеоперационная) таргетная терапия.
Для профилактики местного рецидива используется лучевая терапия, назначение которой зависит от размера первичной опухоли, вида проведенной операции и состояния лимфатических узлов. В случае гормонозависимого заболевания назначается гормональная терапия.
Неоадъювантная терапия
Неоадъювантная терапия — это метод лечения, при котором первым этапом проводится лекарственная терапия для уменьшения опухоли, и лишь после этого решается вопрос о хирургическом вмешательстве.
Распространены два варианта такого лечения в зависимости от состояния пациента, возраста и сопутствующих заболеваний.
Самым эффективным вариантом является лечение по схеме, состоящей из двух химиопрепаратов (доцетаксел и карбоплатин) и двух таргетных анти-HER2 препаратов (трастузумаб и пертузумаб), которые взаимно усиливают друг друга, увеличивая вероятность уменьшения опухоли в размерах. Эта схема химио-таргетной терапии проводится один раз в три недели в течение шести циклов. Через каждые три цикла производится контроль эффекта лечения с помощью УЗИ и/или маммографии. Ограничения для использования этой схемы — пожилой возраст пациентов и наличие выраженных сопутствующих заболеваний.
При наличии противопоказаний к первой схеме может быть предложена схема, состоящая из двух блоков. Первым блоком идет комбинация доксорубицина и циклофосфамида (один раз в две или три недели в течение четырех циклов) с последующей оценкой эффекта терапии и переходом на химио-таргетную терапию: таксан + трастузумаб + пертузумаб в течение 12 недель.
После проведения неоадъювантной химиотерапии встает вопрос о проведении хирургического вмешательства. Его объем зависит от изначальных размеров опухоли, поражения лимфатических узлов, эффекта проведенной терапии.
После операции ткань молочной железы отправляется на гистологическое и иммуногистохимическое исследование. В зависимости от того, какой эффект имела неоадъювантная терапия (полный ответ — это отсутствие опухолевых клеток в образце ткани, неполный ответ — это наличие остаточной опухоли в удаленной молочной железе или лимфатических узлах), решается вопрос о выборе адъювантного лечения.
Адъювантная терапия
Адъювантным называется лекарственное лечение после операции. Оно показано всем пациентам с HER2-позитивным раком молочной железы.
В случае, если после неоадъювантной химио-таргетной терапии и оперативного вмешательства у пациентf развился полный ответ на лечение, стандартным подходом является назначение препарата трастузумаб (один раз в три недели, суммарно до одного года терапии). Такая продолжительной адъювантной таргетной терапии является оптимальной: 6 месяцев терапии оказались недостаточными и уступали по отдаленным результатам, а 24 месяца терапии не продемонстрировали улучшение результатов по сравнению с 12 месяцами.
Если до операции проводилась двойная таргетная блокада (трастузумаб + пертузумаб), такая терапия также должна быть продолжена и после операции в течение 12 месяцев.
Если после проведенного лечения не развился полный ответ (есть остаточная опухолевая ткань, нечувствительная к терапии трастузумабом), это является показанием для назначения препарата трастузумаб эмтанзин (один раз в три недели, 14 циклов в течение первого года терапии).
Если пациент не получал неоадъювантную терапию (в связи с небольшой распространенностью опухолевого процесса), был прооперирован, а на гистологическом исследовании удаленного материала подтвердилась небольшая распространенность опухоли, ему может быть проведена химио-таргетная терапия на основе паклитаксела и трастузумаба. Также возможно присоединение препарата пертузумаб для пациентоd с более распространенным заболеванием (например, при пораженных лимфоузлах).
Как проводится лечение метастатического HER2-позитивного рака молочной железы?
В случае распространенного заболевания в виде метастатического поражения отдаленных органов пациенту будет предложена анти-HER2 терапия и химиотерапия в различных сочетаниях и с определенной последовательностью.
Предпочтительным режимом первой линии лечения является комбинация таксана (в основном доцетаксела), трастузумаба и пертузумаба. Лечение проводится длительно. Химиотерапевтический агент (таксан) обычно может быть убран из схемы через несколько месяцев в зависимости от ответа на терапию и во избежание повышенной токсичности. Однако прием анти-HER2-препаратов продолжается до тех пор, пока данное лечение помогает, иными словами, до прогрессирования заболевания или до возникновения непереносимых побочных явлений.
В случае медленно прогрессирующего заболевания и гормонозависимого рака лечащий врач также может предложить лечение без химиотерапевтического агента. В таком случае параллельно с анти-HER2 препаратами пациент будет получать гормональную терапию.
Одним из значимых преимуществ таргетных препаратов является их способность проникать через гематоэнцефалический барьер (защитный барьер между кровотоком и головным мозгом) и воздействовать на метастазы в головном мозге.
При прогрессировании заболевания могут быть применены другие препараты: трастузумаб эмтанзин, лапатиниб в комбинации с капецитабином, трастузумаб дерукстекан. Возможно возвращение к уже примененным анти-HER2-препаратам (трастузумаб), а также применение еще не одобренных в Российской Федерации веществ, которые пациент имеет право получить в рамках клинических исследований.
Побочные эффекты анти-HER2 терапии
Некоторые побочные эффекты анти-HER2 препаратов схожи с таковыми у химиотерапевтических средств, однако частота и интенсивность их проявления ниже. Это связано с более прицельным действием таргетных веществ, которые наносят вред лишь конкретной популяции клеток, в данном случае опухолевой. Основными побочными эффектами анти-HER2 средств являются:
- кардиотоксичность — воздействие на сердце,
- сыпь,
- диарея.
Воздействие на сердце может проявляться бессимптомным снижением его функции, видимым только при ультразвуковом исследовании — эхокардиографии (эхоКГ = УЗИ сердца). Иногда пациент может жаловаться на симптомы, характерные для сердечной недостаточности. Повреждение сердечной мышцы носит обратимый характер. В связи с риском развития кардиотоксичности пациент, находящийся на анти-HER2 лечении, должен проходить эхоКГ один раз в три месяца.
По результатам исследования таргетная терапия может быть приостановлена. В этот период может быть назначено лечение сердечной недостаточности. Возвращение к таргетной анти-HER2 терапии возможно после восстановления фракции выброса левого желудочка и в том случае, если польза от применения препаратов превосходит ожидаемый риск.
Сыпь больше характерна для схем, в которых используется пертузумаб. В среднем она развивается в 24% случаев лечения препаратом пертузумаб. Диарея более характерна для схем, содержащих лапатиниб (55 %) и пертузумаб (28–72 %).
Выводы
- Появление таргетной терапии позволяет эффективно лечить рак молочной железы с гиперэкспрессией HER2.
- Таргетная анти-HER2 терапия применяется на различных стадиях заболевания.
- Таргетная анти-HER2 терапия может комбинироваться с химиотерапией или гормонотерапией
- Таргетная анти-HER2 терапия активна в отношении метастазов в головном мозге.
Что еще почитать?
- Портал для пациентов американского общества клинической онкологии по лечению HER2-позитивного рака молочной железы (на английском языке)
- Рекомендации для пациентов по лечению метастатического рака молочной железы Американской онкологической сети (на русском языке)
- Памятка онкологического портала Министерства здравоохранения РФ по раку молочной железы.
Обратитесь к врачу
Наши статьи написаны с учетом принципов доказательной медицины. При подготовке материалов мы обращаемся за консультациями к практикующим врачам и ссылаемся на авторитетные источники. Однако все наши тексты носят рекомендательный характер и не заменяют визит к специалисту.

Материалы подготовлены при поддержке Avon.